
資訊中心
作者:香雪生命科學(xué)
發(fā)布時(shí)間:2023-08-15
閱讀:439
近日,國際著(zhù)名期刊Cell Reports Medicine(IF=16.988)刊發(fā)了中國首個(gè)獲批IND批件的TCR-T細胞免疫治療產(chǎn)品TAEST16001的I期臨床研究成果,在此期刊物特邀了美國西北大學(xué)教授為文章作了特別點(diǎn)評并給予高度評價(jià),認為T(mén)AEST16001的I期臨床研究為過(guò)繼性T細胞免疫療法在晚期軟組織肉瘤的臨床轉化中邁出關(guān)鍵一步。


TCR-T細胞免疫治療是指從患者獲取外周血單個(gè)核細胞(PBMC)樣本,通過(guò)基因工程改造的方法,將篩選到的高親和力T細胞受體(T-cell receptor,TCR)導入T細胞,使其能夠識別和攻擊腫瘤細胞。高親和力的TCR-T細胞回輸至患者體內后,可以尋找并特異識別腫瘤細胞,通過(guò)激活機制釋放細胞因子、穿孔素等對腫瘤細胞進(jìn)行連續殺傷,從而發(fā)揮清除腫瘤的效應。
TAEST16001是香雪生命科學(xué)技術(shù)(廣東)有限公司自主研發(fā)的TCR-T細胞免疫治療產(chǎn)品。該產(chǎn)品首個(gè)I期臨床試驗為T(mén)AEST16001細胞在HLA-A*02:01陽(yáng)性并且表達NY-ESO-1抗原的晚期軟組織肉瘤患者中進(jìn)行的劑量遞增和拓展性研究,由中山大學(xué)腫瘤防治中心的張星教授與北京腫瘤醫院的樊征夫教授擔任該研究的領(lǐng)頭研究者(PI)。本文共同第一作者為中山大學(xué)腫瘤防治中心的潘求忠副主任醫生和翁德勝主任醫師及北京腫瘤醫院的劉佳勇教授。
張星教授做為共同通訊作者/主要聯(lián)系人表示目前TCR-T治療軟組織肉瘤是非常具有臨床意義的探索方向,該I期臨床研究結果表明TAEST16001細胞療法耐受性良好,對NY-ESO-1抗原陽(yáng)性的晚期軟組織肉瘤顯示抗腫瘤活性。研究者們對TAEST16001正在進(jìn)行的II期臨床研究充滿(mǎn)期待。
文章要點(diǎn)導讀
• TAEST16001 細胞是高親和力NY-ESO-1特異性TCR-T細胞
• TAEST16001 細胞療法在晚期軟組織肉瘤中耐受性良好
• TAEST16001 細胞療法顯示了良好的抗腫瘤信號
• 多項預先指定的生物標記物與患者反應相關(guān)
文章摘要
NY-ESO-1抗原特異性TCR-T對表達NY-ESO-1抗原的腫瘤有效,但TCR- T細胞治療方案在安全性和有效性方面仍有待改進(jìn)。在這里,我們報道了一項使用靶向NY-ESO-1的親和力增強的TCR-T細胞療法(TAEST16001)的新藥I期臨床研究。入組患者在經(jīng)低劑量的環(huán)磷酰胺(15mg/kg/天×3天)聯(lián)合氟達拉濱(20mg/m2/天×3天)清除淋巴細胞后接受TAEST16001細胞回輸,在回輸細胞后使用低劑量的白介素-2維持體內的TCR-T細胞。12例接受上述方案治療的患者沒(méi)有出現治療相關(guān)的嚴重不良反應。客觀(guān)緩解率(ORR)為41.7%,中位無(wú)進(jìn)展生存期(PFS)為7.2個(gè)月,中位緩解持續時(shí)間(DOR)為13.1個(gè)月。TAEST16001的治療方案為晚期軟組織肉瘤患者提供了安全與有效的治療(ClinicalTrials.gov: NCT04318964)。
關(guān)鍵臨床數據
從2020年3月23日至 2021 年 12 月 31 日,共12名晚期軟組織肉瘤患者入組(10例為滑膜肉瘤,2例為脂肪肉瘤)。
• 男:女比例為7:5
• 平均年齡為33
• 83.3%的患者既往至少接受過(guò)2線(xiàn)化療
安全性數據
• TAEST16001 細胞治療耐受性良好,未觀(guān)察到劑量限制性毒性(DLTs)。未達到最大耐受劑量 (MTD)。
• 最常報告的3級不良事件是淋巴細胞減少癥(100%)、白細胞減少癥(83%)、中性粒細胞減少癥(92%)、貧血(33%),這些事件主要歸因于淋巴細胞清除的先決條件;其他3、4級毒性反應包括發(fā)熱(8%)、血小板減少癥(8%)、低鉀血癥(8%)、丙氨酸氨基轉移酶升高(8%)、蛋白尿(8%)和高甘油三醋血癥(8%)。
• 兩名患者出現細胞因子釋放綜合征,均為2級,并在給予對癥治療后消退。所有患者均未出現神經(jīng)毒性或與細胞輸注相關(guān)的嚴重不良事件。
有效性數據
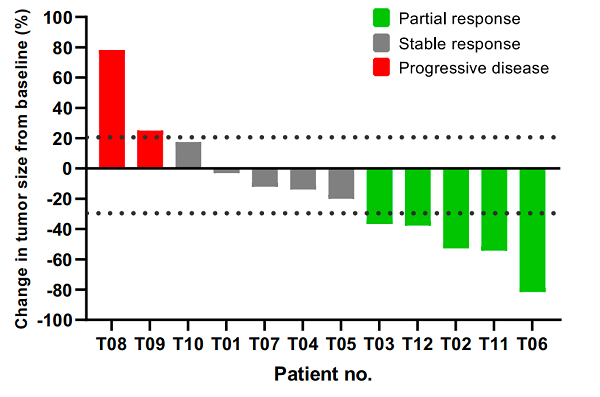
• 所有接受TAEST16001規定細胞劑量的12例患者均符合療效分析條件。
• 在初步分析時(shí),12例患者中有5例的最佳緩解是部分緩解,ORR為41.7% [95% Cl,15.2-72.3];5例(41.7% [95% Cl,15.2-72.3])患者病情穩定,疾病控制率為83.3%[95% Cl, 51.6-97.9]。
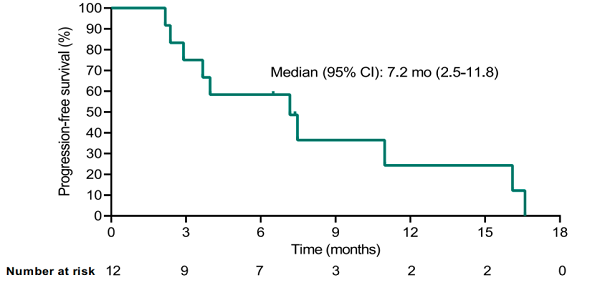
• 中位PFS為7.2個(gè)月[95% CI, 2.5-11.8]。
• 截至數據截止時(shí)(2022年4月15日),10例患者出現疾病進(jìn)展,其中1例因疾病死亡。中位OS尚不成熟。
關(guān)于TAEST16001
TAEST16001是由香雪生命科學(xué)技術(shù)(廣東)有限公司自主研發(fā)的,中國首個(gè)獲得IND批件的TCR-T細胞免疫治療產(chǎn)品。在美國臨床腫瘤學(xué)會(huì )(ASCO)2022年度年會(huì )中,張星教授受邀在肉瘤(Sarcoma)專(zhuān)場(chǎng)會(huì )議中對TAEST16001的I期臨床研究數據進(jìn)行了口頭匯報,結果顯示腫瘤客觀(guān)緩解率(ORR)達到41.7%,其安全性和有效性的臨床研究結果與國外知名藥企同靶點(diǎn)產(chǎn)品的臨床結果相當,獲得了參會(huì )同行的認可和全球業(yè)界的高度關(guān)注。
關(guān)于香雪生命科學(xué)
香雪生命科學(xué)技術(shù)(廣東)有限公司(簡(jiǎn)稱(chēng)“香雪生命科學(xué)”)是一家聚焦TCR領(lǐng)域的細胞免疫治療產(chǎn)品和技術(shù)的研發(fā)企業(yè),是TCR-T細胞免疫治療頭部企業(yè)。公司以“解決人類(lèi)健康難點(diǎn),樹(shù)立腫瘤治療標桿”為愿景,以“聚焦TCR,賦能T細胞,攻克實(shí)體瘤”為使命。
香雪生命科學(xué)具有自主知識產(chǎn)權的TCR核心技術(shù),擁有完整的TCR-T產(chǎn)品研發(fā)技術(shù)體系和生產(chǎn)制備體系,其中TCR-T產(chǎn)品研發(fā)技術(shù)體系包含:①抗原肽發(fā)現平臺,②TCR高親和力平臺,③TCR-T開(kāi)發(fā)平臺;TCR-T生產(chǎn)制備體系包含:①自動(dòng)化細胞生產(chǎn)平臺,②質(zhì)控平臺;已形成了TCR-T細胞產(chǎn)品全鏈條創(chuàng )新產(chǎn)業(yè)鏈。香雪生命科學(xué)研發(fā)技術(shù)體系產(chǎn)生豐富的在研及儲備管線(xiàn),涵蓋實(shí)體腫瘤相關(guān)專(zhuān)有靶點(diǎn)和覆蓋中國人群的HLA分型的產(chǎn)品,處于國際領(lǐng)先水平。
目前,香雪生命科學(xué)有兩個(gè)產(chǎn)品已在中國獲得IND批件,其中第一個(gè)產(chǎn)品是TAEST16001,適應癥為軟組織肉瘤,目前正在進(jìn)行II期臨床研究;第二個(gè)產(chǎn)品是TAEST1901,適應癥為原發(fā)性肝癌,即將啟動(dòng)I期臨床研究。
原文鏈接:https://doi.org/10.1016/j.xcrm.2023.101133