
資訊中心
作者:香雪生命科學(xué)-孫含麗
發(fā)布時(shí)間:2024-07-02
閱讀:175
隨著(zhù)現代醫學(xué)技術(shù)的不斷發(fā)展,癌癥治療領(lǐng)域迎來(lái)了越來(lái)越多的創(chuàng )新療法。其中,抗體偶聯(lián)藥物(Antibody-drug Conjugate,簡(jiǎn)稱(chēng)ADC)以其獨特的優(yōu)勢,成為了近年來(lái)備受矚目的新型治療方式。ADC藥物由靶向腫瘤細胞過(guò)度表達的表面受體的抗體、高活性的細胞毒素小分子和連接子3個(gè)部分組成。其中,抗體部分負責將ADC藥物分子精準運送至靶細胞表面,連接子負責在靶細胞內或表面釋放毒素小分子,而高活性的細胞毒素小分子則高效地殺傷腫瘤細胞。 ADC藥物兼具了小分子藥物的強大殺傷力和純單抗的高靶向性,如同“生物導彈”一般,能夠精準地打擊腫瘤細胞,減少治療過(guò)程中的不良反應。
截至2024年4月全球已有15款ADC藥物獲批上市,2023年ADC藥物全球銷(xiāo)售額突破百億美元,處于各研發(fā)階段的ADC藥物分子更是超過(guò)800個(gè),而且呈現逐年快速增長(cháng)的趨勢,有望給腫瘤患者帶來(lái)更有效的治療藥物。
經(jīng)典的ADC藥物由單克隆抗體、連接子和毒素小分子3部分組成(圖1)。每個(gè)組成部分發(fā)揮著(zhù)不同的功能:抗體部分負責將ADC分子選擇性地遞送至腫瘤細胞表面,同時(shí)通過(guò)靶點(diǎn)介導的內吞作用進(jìn)入到細胞內;連接子則負責在腫瘤細胞內或者表面高效釋放毒素小分子,而在血液循環(huán)系統中保持穩定;毒素小分子則負責高效地殺傷腫瘤細胞。因此,ADC藥物每個(gè)組成部分的特性都對其發(fā)揮靶向治療作用至關(guān)重要,同時(shí)各個(gè)組分的選擇也都可能會(huì )影響到ADC的安全性和有效性。
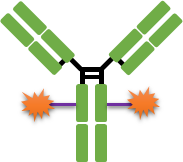
圖1 經(jīng)典ADC藥物的結構
本文將從構建ADC時(shí)需要考慮的核心要素,包括靶點(diǎn),抗體、連接子、毒素小分子以及偶聯(lián)技術(shù)等方面概述其研究進(jìn)展,討論目前ADC藥物開(kāi)發(fā)所面臨的挑戰和機遇。
1、 靶點(diǎn)
ADC作用機制始于與靶細胞上表達的靶抗原的結合,因此,選擇合適的靶點(diǎn)是ADC藥物首要考慮因素之一。理想的靶點(diǎn)應該具備以下特點(diǎn):組織特異性強、抗原穩定性高、抗原高效內化。目前獲批ADC藥物針對的靶抗原通常是癌細胞過(guò)表達的特異性蛋白:HER2、CD19、CD22、CD30、CD33、CD79b、BCMA、Nectin-4、EGFR、TissueFactor、FRα和Trop2。在研ADC藥物的熱門(mén)靶點(diǎn)集中在:HER2、Trop2、EGFR、c-Met、B7-H7、HER3、Nectin-4、CLDN18.2、PDL1等多個(gè)成熟的靶點(diǎn)。
2、抗體
作為ADC藥物的主體框架結構和導航系統,理想的抗體組分需具備較低的免疫原性、特異性的靶點(diǎn)結合和高親和力、較長(cháng)的半衰期、良好的血液循環(huán)系統穩定性以及能介導高效的內吞效應等特性。早期的ADC藥物采用鼠源抗體,通常會(huì )在病人體內引發(fā)較強的免疫反應,產(chǎn)生抗藥抗體,進(jìn)而導致療效降低和其他副反應。后來(lái),為了克服免疫原性這一缺點(diǎn),改進(jìn)和優(yōu)化出了人鼠嵌合抗體和人源化抗體,大大降低了免疫原性風(fēng)險。除免疫原性外,抗體的高選擇性和特異性也對ADC藥物的安全性和有效性至關(guān)重要,它使得ADC藥物能通過(guò)結合靶標而富集在腫瘤組織中,而與正常組織不結合或者較低結合。ADC藥物的藥效與抗體-靶點(diǎn)抗原的親和力密切相關(guān),目前大部分的ADC與靶點(diǎn)的親和力在0.1~1.0 nmol/L的范圍內。在設計ADC藥物時(shí),選擇靶點(diǎn)親和力適當的抗體對于其內吞和藥效非常關(guān)鍵。
近些年,除了利用單克隆抗體作為載具的ADC外,也有很多研究嘗試使用其他形式的抗體,例如雙抗、抗體片段或納米抗體等來(lái)開(kāi)發(fā)ADC,以期進(jìn)一步提高ADC藥物的安全性和有效性。
雙抗是一種在單抗的基礎上設計出的能同時(shí)識別和結合兩種不同抗原或同一抗原兩個(gè)不同表位的一類(lèi)抗體分子。目前的研究數據表明,有的雙抗ADC能提高腫瘤細胞靶向性,增強靶點(diǎn)介導的內吞作用,從而提高藥效,降低對正常組織的毒性。
ADC藥物目前面臨的挑戰之一是分子質(zhì)量過(guò)大,難于穿越各種生物屏障到達并穿透實(shí)體瘤腫瘤組織,影響其治療實(shí)體瘤的效果。為了提高ADC藥物治療實(shí)體瘤的效果,研究者們希望通過(guò)縮小抗體框架結構來(lái)降低ADC的總體分子大小,增強其腫瘤穿透力。作為ADC藥物的框架結構,這些縮小版的抗體首先必須保留其抗原抗體結合能力,如天然抗體的組件F(ab)2、F(ab)2'、Fab和Fv片段等。另外,通過(guò)抗體工程改造獲得的scFv以及Diabody等則有更好的穩定性和靶向效率。還有一類(lèi)縮小版抗體則是人源化的非典型抗體片段,如來(lái)源于駱駝和羊駝的VHH片段,以及來(lái)源于鯊魚(yú)的VNAR片段等,這一類(lèi)通常被稱(chēng)為納米抗體。這3種縮小版的抗體都已被用于探索開(kāi)發(fā)縮小版ADC。
3、連接子
連接子負責將ADC的抗體和細胞毒小分子鏈接在一起,對于A(yíng)DC藥物的安全性和穩定性至關(guān)重要。理想的連接子需要在血液循環(huán)中足夠穩定,能有效避免ADC藥物在血液循環(huán)中和正常組織中釋放毒素小分子并使之保持穩定且非活性狀態(tài),而同時(shí)又需要能在腫瘤組織和細胞內高效釋放毒素小分子。
連接子一般包括4個(gè)分子片段:抗體連接片段、調節片段、酶降解片段和自裂解片段。開(kāi)發(fā)者通常依據毒素小分子的特性以及與抗體連接的方式,并結合對ADC分子的影響,開(kāi)展綜合分析評估來(lái)篩選上述4個(gè)片段,最終確定連接子的結構。
4、毒素小分子
毒素小分子是ADC藥物中主要負責執行細胞殺傷功能的組件,它需要具備較高的活性使之能在較低的劑量下有效殺傷腫瘤細胞。同時(shí),它還需要具備很好的穩定性,使之在循環(huán)系統和溶酶體中保持結構完整和活性。另外,它還需要分子質(zhì)量足夠小,免疫原性低,也需具備方便與連接子進(jìn)行化學(xué)反應的位點(diǎn)。目前常見(jiàn)的毒素小分子主要包括微管蛋白抑制劑和DNA復制的抑制劑,隨著(zhù)日本第一三共公司的重磅ADC藥物Enhertu®應用拓撲異構酶抑制劑的成功,越來(lái)越多的細胞毒性相對較低的小分子進(jìn)入到ADC藥物開(kāi)發(fā)者的工具箱,如針對拓撲異構酶的喜樹(shù)堿類(lèi)、RNA聚合酶抑制劑、細胞凋亡調控藥物等。
5、偶聯(lián)技術(shù)
ADC藥物開(kāi)發(fā)成功的另一個(gè)重要元素是將小分子組分(連接子或連接子-毒素小分子)加載在抗體分子上的方式和技術(shù)。偶聯(lián)反應策略和過(guò)程,決定了載藥量(drug antibody ratio,DAR)和載藥分布方式等關(guān)鍵質(zhì)量屬性,與ADC藥物的有效性和安全性直接相關(guān)。理想的ADC偶聯(lián)策略或技術(shù)需具備如下特點(diǎn):a. 抗體與小分子結合部分的化學(xué)鍵或基團應足夠穩定,確保其在循環(huán)系統中的穩定性;b. 偶聯(lián)位點(diǎn)不會(huì )干擾抗體的功能,特別是與靶點(diǎn)抗原結合的特異性和高親和力;c. 偶聯(lián)過(guò)程涉及的反應必須有足夠高的選擇性和反應效率,同時(shí)應易于控制載藥量和載藥分布。
目前的ADC偶聯(lián)技術(shù)大致可以分為兩種類(lèi)別,一種是利用抗體序列中天然的具備反應活性的氨基酸殘基(如表面賴(lài)氨酸的側鏈氨基和鏈間二硫鍵還原后的巰基)來(lái)介導的偶聯(lián)技術(shù),目前已上市的大多數ADC藥物采用此類(lèi)偶聯(lián)技術(shù);另一類(lèi)技術(shù),則是通過(guò)化學(xué)修飾、基因工程技術(shù)或者酶修飾等手段在抗體特定位點(diǎn)引入可供反應的基團,再偶聯(lián)上毒素小分子,實(shí)現特定位點(diǎn)偶聯(lián)。此類(lèi)技術(shù)主要包括工程化半胱氨酸定點(diǎn)插入、非天然氨基酸定點(diǎn)插入、酶介導以及N-糖鏈介導的偶聯(lián)技術(shù)等。
6、ADC藥物未來(lái)發(fā)展方向
從第一個(gè)ADC藥物在2000年獲批上市到現在的20多年間,共計15款ADC藥物獲批上市,這期間ADC藥物已經(jīng)在偶聯(lián)技術(shù)、連接子和毒素小分子方面取得顯著(zhù)發(fā)展,使得其療效和安全性得到了很大的提高,也吸引了學(xué)術(shù)界和工業(yè)界對該領(lǐng)域的持續關(guān)注和研究投入,同時(shí)使得ADC技術(shù)得到了更進(jìn)一步的快速發(fā)展,為未來(lái)ADC藥物的設計和開(kāi)發(fā)提供了廣闊的前景。
在A(yíng)DC藥物的靶點(diǎn)選擇方面,除了腫瘤細胞表面靶點(diǎn)外,腫瘤微環(huán)境的靶點(diǎn)是該領(lǐng)域的新熱點(diǎn)之一。此類(lèi)靶點(diǎn)通常包括腫瘤微環(huán)境(tumor microenvironment,TME)中的表皮細胞和成纖維細胞抗原。此類(lèi)靶點(diǎn),因其分布在腫瘤組織周?chē)饶[瘤組織更容易從血液循環(huán)接觸到ADC分子;再者,此類(lèi)組織細胞比起腫瘤細胞受到基因突變影響小的多,因此產(chǎn)生耐藥性的可能性也降低;作用于此類(lèi)靶點(diǎn)除了能運用毒素小分子殺傷腫瘤細胞外,還可能產(chǎn)生抗血管生成等協(xié)同抑制腫瘤增殖的作用;最重要一點(diǎn),TME抗原很少或者幾乎不在正常組織表達。LRRC15(leucine-rich repeat containing 15)就是此類(lèi)靶點(diǎn)的代表,它在多種腫瘤的微環(huán)境里的成纖維細胞膜表面有高表達,而在正常組織不表達。
由于目前限制ADC效力的一個(gè)重要因素是其分子尺寸太大,使之不容易穿透毛細血管以及腫瘤基質(zhì)等屏障到達腫瘤細胞,從而阻礙了其在實(shí)體瘤治療方面的效果。因此,針對這一局限性,研究者們嘗試了各種手段縮小ADC尺寸,包括前述的抗體片段或納米抗體等形式的ADC。此外,還有一類(lèi)利用更小尺寸非抗體框架的ADC,其抗體部分由一段有靶向結合能力的多肽替代以進(jìn)一步增加其穿透力。此類(lèi)ADC開(kāi)發(fā)的最大挑戰就是其血液清除率太快,將來(lái)如能克服此缺點(diǎn)將會(huì )進(jìn)一步拓展其治療適應癥,如腦腫瘤和一些血管分布很少的實(shí)體瘤。
另一些嘗試主要是在載荷方面,如通過(guò)在抗體上偶聯(lián)兩種不同的細胞毒小分子,以應對腫瘤組織中癌細胞的高度異質(zhì)性和耐藥性。
此外,還有將ADC中傳統的細胞毒小分子載荷替換為蛋白毒素、細胞因子、蛋白降解靶向嵌合體(proteolysis-targeting chimeras,PROTAC)和小核酸作為載荷,用于治療癌癥和其他疾病。
相信在A(yíng)DC領(lǐng)域研究者的共同努力下,克服現有ADC的缺點(diǎn)和挑戰,下一代的ADC藥物將會(huì )給腫瘤的靶向治療帶來(lái)新驚喜,使更多的腫瘤患者獲益。另外,作為一種遞送系統,相信將來(lái)ADC藥物必將用于更加廣泛的領(lǐng)域,如中樞神經(jīng)疾病、遺傳疾病和感染性疾病等領(lǐng)域,作為真正高效的“魔法子彈”去消滅疾病,拯救生命。