
資訊中心
作者:香雪生命科學(xué)-李柳萍
發(fā)布時(shí)間:2022-05-31
閱讀:10931
在過(guò)去的幾十年中,以質(zhì)譜(MS)為基礎的蛋白質(zhì)組學(xué)已經(jīng)成為鑒定蛋白質(zhì)-蛋白質(zhì)相互作用分析(PPIs)的重要技術(shù)。
作為生命活動(dòng)的主要承擔者,蛋白質(zhì)的功能一直是科研活動(dòng)中備受關(guān)注的明星。蛋白質(zhì)通常不是“單打獨斗”的,絕大多數的功能蛋白質(zhì)通過(guò)與其它蛋白質(zhì)或化合物相互作用,形成大分子化合物,從而發(fā)揮生物學(xué)功能。迄今已經(jīng)發(fā)展出了多種用于研究蛋白質(zhì)相互作用的技術(shù)和方法,例如免疫共沉淀,Pull Down,雙分子熒光互補技術(shù)等。
1、免疫共沉淀
免疫共沉淀(CO-Immunoprecipitation,CO-IP)基于抗原與抗體的專(zhuān)一性結合的實(shí)驗方法。簡(jiǎn)單來(lái)說(shuō),就是抗原與抗體是鎖與鑰匙之間的關(guān)系,一把鑰匙(抗體)只能開(kāi)一把鎖(抗原),而鑰匙(抗體)可以通過(guò)鑰匙鏈(細菌蛋白的“protein A/G)快速找到。利用抗原A與蛋白B結合,通過(guò)A的抗體(鑰匙)沉淀A(鎖),再利用精制的protein A/G(鑰匙鏈)預先結合到磁珠上,使之與含有抗原的溶液及抗體反應后,磁珠上的protein A/G就能吸附抗原,從而獲得抗原A與蛋白B的復合體,之后就可以對B進(jìn)行檢測,從而獲得蛋白質(zhì)與蛋白質(zhì)相互作用的信息。CO-IP是廣泛應用于檢測生理條件下蛋白質(zhì)與蛋白質(zhì)之間的相互作用的經(jīng)典方法。
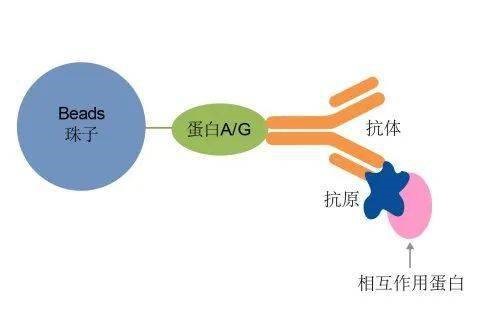
CO-IP原理示意圖
通常情況下,若實(shí)驗前已經(jīng)對這些可能的互作蛋白有了猜測,可以將大顆粒物拖拽下來(lái)的蛋白復合體進(jìn)行SDS-PAGE。再用 western-blot 的方法,用這些可能的互作蛋白的抗體去進(jìn)行檢測,就能驗證這種蛋白質(zhì)之間的相互作用了。
若想找一些以前未被報道,無(wú)法猜測的互作蛋白呢?這個(gè)時(shí)候,可以把免疫共沉淀后得到的樣品,做蛋白組學(xué),通過(guò)質(zhì)譜對這個(gè)復合體中的所有成員進(jìn)行鑒定,理論上你就獲得了整個(gè)目標蛋白復合體的成員信息。
2、Pull Down
Pull-down技術(shù)用固相化的、已標記的餌蛋白或標簽蛋白(生物素-、PolyHis-或GST-),從細胞裂解液中釣出與之相互作用的蛋白。通過(guò)Pull-down技術(shù)可以確定已知的蛋白與釣出蛋白或已純化的相關(guān)蛋白間的相互作用關(guān)系,從體外轉路或翻譯體系中檢測出蛋白相互作用關(guān)系。
Pull-Down的概念與CO-IP類(lèi)似,其目的是研究與已知誘餌蛋白結合的蛋白或配體。Pull-Down旨在證明兩種蛋白質(zhì)之間的相互作用或探索可與目的蛋白結合的未知蛋白或分子。Pull-Down不同于IP或CO-IP之處在于,它不是基于抗體-抗原相互作用,不是免疫反應。CO-IP檢測到的蛋白互作關(guān)系可能是第三個(gè)蛋白作為橋梁建立的,與之相比,pull down技術(shù)可用于檢測蛋白之間的直接互作關(guān)系。但pull down需要先把誘餌蛋白原核表達純化出來(lái),再與目的蛋白溶液孵育,其無(wú)法像CO-IP一樣模擬細胞內天然的互作環(huán)境。
GST pull down(GST融合蛋白沉降技術(shù))是體外檢測蛋白相互作用的常用方法,1988年Smith等利用谷胱甘肽-S-轉移酶(GST)融合標簽從細菌中一步純化出GST融合蛋白,從此GST融合蛋白在蛋白質(zhì)相互作用研究領(lǐng)域里得到了極大的推廣。
GST Pull-Down實(shí)驗基于GST(glutathione-S-transferase),即谷胱甘肽-S-轉移酶蛋白,可以與谷胱甘肽(Glutathione,GSH)結合。將GSH固定于瓊脂糖珠上,形成GSH-瓊脂糖珠,將已知蛋白X與GST融合表達,獲得的GST-X可與GSH-瓊脂糖珠結合,若環(huán)境中存在與X蛋白互做的蛋白Y,則會(huì )形成“瓊脂糖珠-GSH-GST-X-Y”復合物,與X蛋白互做的蛋白即可被分離并檢測。
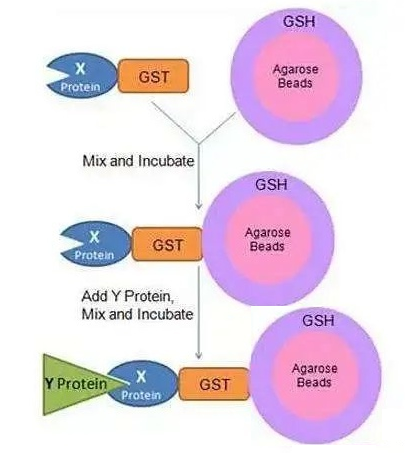
GST-Pull-Down原理示意圖
一般來(lái)說(shuō),GST融合蛋白pull down方法用于兩個(gè)方面:一是鑒定能與已知融合蛋白相互作用的未知蛋白質(zhì);二是鑒定兩個(gè)已知蛋白質(zhì)之間是否存在相互作用。
除了GST以外,類(lèi)似的融合蛋白很多,如與葡萄球菌蛋白A融合的“誘餌”蛋白可以通過(guò)固定有IgG的色譜柱進(jìn)行純化;與寡聚組氨酸肽段融合的“誘餌”蛋白可以通過(guò)結合Ni2+ 的色譜柱進(jìn)行純化;與二氫葉酸還原酶融合的“誘餌”蛋白可以通過(guò)固定有氨甲蝶呤的色譜柱進(jìn)行純化等等。
3、雙分子熒光互補技術(shù)
雙分子熒光互補技術(shù)BiFC(Bimolecular Fluorescence Complementation),該技術(shù)是利用熒光蛋白的特點(diǎn)來(lái)研究蛋白的相互作用。將熒光報告蛋白按照規則分成沒(méi)有熒光的兩段N-fragment及C-fragment,分別與誘餌蛋白和捕獲蛋白融合,只有在誘餌蛋白和捕獲蛋白發(fā)生相互作用的情況下,兩段不完整的熒光報告蛋白才會(huì )形成完整的報告蛋白,發(fā)出熒光。活細胞收集后,在流式細胞儀中的檢測是實(shí)時(shí)進(jìn)行的,只要細胞中有熒光產(chǎn)生就會(huì )被捕捉到信號,因此,不論是親和力較弱的結合還是暫時(shí)性的結合都不會(huì )被遺漏。可視化是 BiFC 技術(shù)最大的特點(diǎn)。

BiFC原理示意圖
BiFC在沿襲蛋白質(zhì)片段互補技術(shù)的基礎上進(jìn)行了優(yōu)化,蛋白質(zhì)互補技術(shù)中功能蛋白的活性由底物反應所體現,通過(guò)檢測底物變化來(lái)判斷蛋白質(zhì)的相互作用,而B(niǎo)iFC技術(shù)則是利用熒光蛋白本身能夠自我催化形成熒光活性中心并產(chǎn)生熒光蛋白的特征光譜的特點(diǎn),直接反映蛋白質(zhì)之間的相互作用,技術(shù)過(guò)程更加簡(jiǎn)單,結果更加直觀(guān)。
目前常用于BiFC系統的熒光蛋白有GFP(green fluorescent protein,綠色熒光蛋白)、YFP(yellow fluorescent protein,黃色熒光蛋白)、CFP(cyan fluorescent protein,青色熒光蛋白)、BFP(blue fluorescent protein,藍色熒光蛋白)、RFP(red fluorescent protein,紅色熒光蛋白)、Venus、citrine、cerulean、mCherry等。Venus是目前最常用于BiFC分析的熒光蛋白,因為其熒光強,背景敏感度低,是BiFC系統理想的熒光蛋白。
研究蛋白質(zhì)相互作用是BiFC系統最主要應用,迄今各種BiFC系統已經(jīng)被成功用于多種蛋白質(zhì)的相互作用,例如體外、病毒、大腸桿菌、酵母細胞、絲狀真菌、哺乳動(dòng)物細胞、植物細胞、甚至個(gè)體水平的蛋白質(zhì)之間相互作用研究。除了能夠驗證蛋白質(zhì)之間是否存在相互作用,BiFC系統還能夠對細胞內蛋白相互作用位置進(jìn)行研究。
BiFC也可用于藥物開(kāi)發(fā),首先選取疾病相關(guān)的重要蛋白,基于BiFC技術(shù)開(kāi)發(fā)BiFC穩轉細胞株,不同的藥物處理后檢測熒光信號就可篩選潛在的治療藥物,具有良好的應用前景。