
資訊中心
作者:香雪精準醫療---張海霞
發(fā)布時(shí)間:2020-05-09
閱讀:11582
CRISPR(Clustered regularly interspaced short palindromic repeats)是原核生物基因組內的一段重復序列,是生命進(jìn)化歷史上,細菌和病毒進(jìn)行斗爭產(chǎn)生的免疫武器,簡(jiǎn)單說(shuō)就是病毒能把自己的基因整合到細菌,利用細菌的細胞工具為自己的基因復制服務(wù),細菌為了將病毒的外來(lái)入侵基因清除,進(jìn)化出CRISPR-Cas系統,利用這個(gè)系統,細菌可以不動(dòng)聲色地把病毒基因從自己的基因組上切除,這是細菌特有的免疫系統。這個(gè)系統由CRISPR序列與CAS(CRISPR associate system)兩個(gè)核心部分組成。CRISPR序列是由噬菌體DNA片段衍生來(lái)的。它可以檢測并摧毀能引起相似感染的其他噬菌體中相似的DNA,因此對原核生物抗噬菌體至關(guān)重要。CAS是一種核酸內切酶,可以利用CRISPR序列中間隔序列(spacer)對應的RNA指引,識別并且切割特定與其序列互補的DNA鏈。以最常用的CRISPR/Cas9為例,該系統由反式激活 CRISPR RNA(tracrRNA)基因,CRISPR 重復-間隔基因和CAS9基因組成。這三部分轉錄生成TracrRNA,Pre-crRNA,還有Cas9蛋白,并組成復合體。這個(gè)被激活的復合體會(huì )在細菌內部隨機的來(lái)尋找適合的原間隔序列臨近基序(PAM)進(jìn)行外來(lái)DNA篩查。根據對PAM序列的識別,Cas9-RNA復合體將PAM后10-12堿基位的DNA解旋審查。如果被審查的DNA序列與crRNA序列匹配,Cas9內切酶中的HNH核酸酶結構域就會(huì )將其切斷;同時(shí)Cas9中RuvC-like核酸酶結構區域將另一條互補鏈切斷(圖1)。
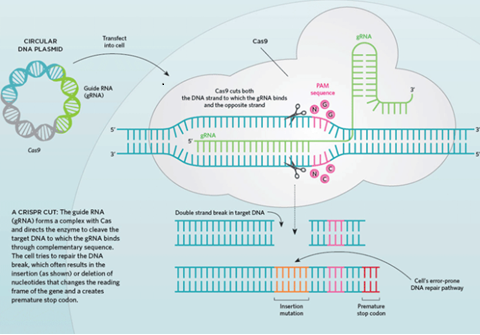
Figure 1 Non-homology end joining (NHEJ) of CRISPR-Cas9 system
CRISPR-Cas9是革命性的基因編輯,它可以在含有成千上萬(wàn)基因的基因組中精確地切割指定DNA雙鏈,伴隨著(zhù)切割工作的是細胞損傷修復。修復一般通過(guò)兩種方式:在酶的幫助下把兩個(gè)懸空的末端粘合,通常這會(huì )導致1個(gè)或多個(gè)堿基的增加或刪除,這會(huì )破壞基因功能(圖1),達到敲除基因的目的;另一些酶可以用一段DNA單鏈匹配被剪切的DNA片段的上游和下游序列,建立互補DNA鏈完成雙鏈修復(圖2)。前者被稱(chēng)為非同源末端連接,是CRISPR切割導致的最常見(jiàn)情況。后者被稱(chēng)為同源定向修復,發(fā)生的頻率根據不同細胞類(lèi)型具有選擇性?xún)A向。
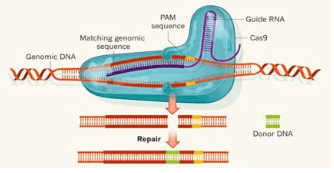
Figure 2 Homologous recombination repair (HR) of CRISPR-Cas9 system
盡管世人對CRISPR-Cas9基因編輯抱有很高期望,科學(xué)家們仍對其人體臨床應用持懷疑態(tài)度。為什么呢?按哥倫比亞大學(xué)Sam Sternberg教授的說(shuō)法,現在的CRISPR工具就像是分子剪刀。它們能剪開(kāi)DNA,但實(shí)際上的編輯工作是交給了細胞自身的修復機制,目前還沒(méi)人知道把它放入細胞后真正會(huì )發(fā)生什么,我們并沒(méi)有真正理解過(guò)這一過(guò)程是如何運作的。這套機制在過(guò)去已被證明行之有效,但也暴露出了不少潛在的問(wèn)題,譬如許多細胞在修復DNA時(shí),會(huì )引入一些錯誤。又譬如一些細胞在雙鏈DNA斷裂之后,會(huì )出現意想不到的副作用。為了突破傳統工具的局限,研究人員們決定引入不依賴(lài)細胞本身修復機制的基因編輯元件。最近,研究人員從霍亂弧菌體內發(fā)現一種“轉座子”(Tn7-like transposons),也稱(chēng)跳躍基因。顧名思義,它們能夠讓基因發(fā)生“跳躍”,并整合到基因組的不同位點(diǎn)中。研究人員們指出,這種整合功能并不涉及同源重組修復,也就是經(jīng)典CRISPR-Cas系統的編輯方法。利用CRISPR聯(lián)合這種轉座子,研究人員們開(kāi)發(fā)了一種全新的基因編輯系統。與其說(shuō)它是一把“剪刀”,不如說(shuō)它是一管“膠水”。利用CRISPR體系,它前往基因組的特定位點(diǎn)。隨后,它能以一種高度可控的方法,把外源基因整合入基因組(圖3)。實(shí)驗結果表明,他們能將任何不超過(guò)10kb的DNA序列插入到任何細菌基因組的特定位點(diǎn)。這套全新的工具帶來(lái)了全新的應用前景。研究人員們指出,這有望讓CRISPR基因編輯工具在保持簡(jiǎn)便使用的同時(shí),避免與DNA斷裂相關(guān)的潛在副作用[1]。
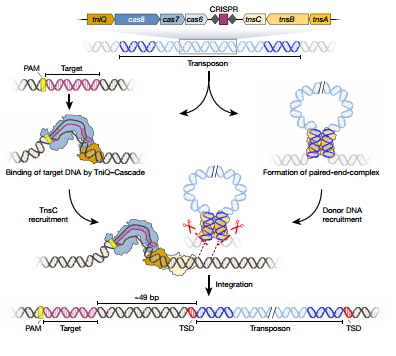
Figure 3 Proposed model for RNA-guided DNA integration by Tn7-like
transposons encoding CRISPR–Cas systems.
CRISPR/Cas系統想要精確地切割指定DNA雙鏈,除了需要作為識別重點(diǎn)的CRISPR序列,還需要另外一個(gè)重要的序列PAM。如果沒(méi)有對應的PAM,就啟動(dòng)不了CRISPR/Cas系統。PAM根據Cas酶的種類(lèi)不同而有所不同,目前使用最廣泛的是來(lái)自化膿鏈球菌的SpCas9,主要識別的是NGG序列。這就意味著(zhù)它并不能夠隨我們所欲地編輯所有的基因片段。而一項最新的研究則完全放開(kāi)了CRISPR/Cas9的束縛,現在“基因魔剪”可以說(shuō)是真的“想剪哪里就剪哪里啦”。對蛋白來(lái)說(shuō),結構決定功能。SpCas9識別NGG,主要是通過(guò)R1333和R1335兩個(gè)位置氨基酸側鏈和鳥(niǎo)嘌呤的結合。科學(xué)家通過(guò)比對SpCas9-VQR、SpCas9-VRQR等前人開(kāi)發(fā)的變體和它們識別的PAM序列,很快提出了幾個(gè)可能的氨基酸取代方案,并通過(guò)一種高通量測試PAM活性的方法(HT-PAMDA)來(lái)分析變體對PAM的偏好。最終,在各種氨基酸取代組合方案里,研究者們獲得了一種能夠基本等效識別NGA、NGC、 NGG、NGT的變體,它具有五個(gè)氨基酸取代(D1135L/S1136W/G1218K/E1219Q/R1335Q/T1337R),被命名為SpG。搞定了NGN后,研究者們進(jìn)一步把R1333位置替換成丙氨酸、半胱氨酸或脯氨酸。經(jīng)過(guò)一系列細化和篩選,最終研究者們開(kāi)發(fā)出了SpG(L1111R/A1322R)2.0版SpRY,可識別NRN(R為A+G)。不言而喻,SpG和SpRY大大擴大了CRISPR/Cas系統的極限,幾乎整個(gè)基因組都“觸手可及”了[2]!另外,根據實(shí)驗數據,SpG和SpRY的脫靶效應與SpCas9水平接近,新增的脫靶問(wèn)題主要來(lái)源于擴展大的PAM范圍,而另外一種HF1變體則能夠消除這類(lèi)脫靶并提升編輯效率。
十幾年前,當研究人員開(kāi)始解析CRISPR結構的時(shí)候,他們并沒(méi)有預料到這會(huì )給基因編輯世界帶來(lái)一場(chǎng)革命性風(fēng)暴。這種突破性的技術(shù)影響極其深遠,從改變老鼠皮毛的顏色到設計不傳播瘧疾的蚊子和抗蟲(chóng)害作物,再到修正鐮狀細胞性貧血等各類(lèi)遺傳疾病,突變CCR5基因抵抗艾滋病等等[3]。該技術(shù)具有非常精準、廉價(jià)、易于使用,并且非常強大的特點(diǎn)。隨著(zhù)CRISPR技術(shù)的逐漸完善、升級,只要能正確合理的利用,CRISPR將極大地推動(dòng)生命科學(xué)的發(fā)展與進(jìn)步。
參考文獻:
[1]Sanne E. Klompe, et al. (2019), Transposon-encoded CRISPR–Cas systems direct RNA-guided DNA integration, Nature, DOI: https://doi.org/10.1038/s41586-019-1323-z
[2] Walton RT, Christie KA, Whittaker MN, Kleinstiver BP.(2020),Unconstrained genome targeting with near-PAM less engineered CRISPR-Cas9 variants. Science, Doi: 10.1126/science.aba8853.
[3] Leonova EI, Gainetdinov RR.(2020),CRISPR/Cas9 Technology in Translational Biomedicine. Cell Physiol Biochem. , Doi: 10.33594/000000224.