
資訊中心
作者:來(lái)源:醫藥魔方微信公眾號
發(fā)布時(shí)間:2020-01-14
閱讀:11796
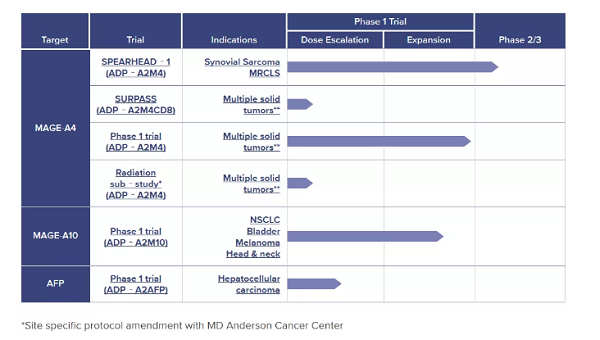
1月13日,Adaptimmune Therapeutics在第38屆JP摩根大會(huì )上公布了旗下基于SPEAR T-cell技術(shù)平臺開(kāi)發(fā)的TCR-T療法對實(shí)體瘤患者的積極早期數據,其中有1例肝癌和1例黑色素瘤患者實(shí)現經(jīng)確證的部分應答(PR),另有1例胃食管連接部癌和1例頭頸癌患者實(shí)現未經(jīng)確證的部分應答。
此前已有ADP-A2M4研究的早期數據證明了其TCR-T療法對滑膜肉瘤的療效。此次公布的數據則進(jìn)一步證明了Adaptimmune公司針對多種實(shí)體瘤的SPEAR T-cell技術(shù)平臺的巨大潛力。受此消息刺激,Adaptimmune公司股價(jià)在1月13日以暴漲200%收盤(pán)。
具體而言,ADP-A2AFP的I期研究第3個(gè)隊列入組的第1例肝細胞患者實(shí)現了確證后的部分應答,目標病灶縮小了100%。
ADP-A2M4 的I期研究低劑量組的第1例直腸黏膜黑色素瘤患者實(shí)現了經(jīng)確證的部分應答,目標病灶縮小了42%。擴展研究階段的1例頭頸癌患者實(shí)現了未經(jīng)確證的部分應答,目標病灶縮小了36%。
I期SURPASS研究第1個(gè)隊列的1例轉移性胃食管連接部癌患者實(shí)現了未經(jīng)確證的部分應答,目標病灶縮小了42%。
安全性方面,這些研究中患者的不良事件與大多數患者經(jīng)歷化療或免疫治療后的常見(jiàn)不良事件一致。細胞因子風(fēng)暴、神經(jīng)毒性的發(fā)生情況與其他CAR-T療法一致,并且都可以按照指南進(jìn)行管理。
SPEAR T-cell技術(shù)平臺主要針對黑色素瘤抗原(melanoma—associated antigen,MAGE)家族蛋白開(kāi)發(fā)多種T細胞免疫療法。MAGE家族由60多個(gè)基因組成,其中很多基因表達的蛋白是癌癥中高表達的腫瘤抗原,并在腫瘤形成過(guò)程中起到至關(guān)重要的作用。Adaptimmune公司的TCR-T產(chǎn)品主要針對MAGE-A4、MAGE-A10、甲胎蛋白(AFP)等靶點(diǎn)。
Adaptimmune公司首席執行官Adrian Rawcliffe表示:“這些應答數據顯示了我們的SPEAR T-cell技術(shù)平臺在克服CAR-T療法用于治療多種實(shí)體瘤所面臨障礙的巨大潛力。當然,目前的數據還比較早期,我們還需要更多患者的數據和更多的應答持續時(shí)間數據,才能決定選擇哪種適應癥進(jìn)一步開(kāi)發(fā)。但不管如何,這些結果仍然是對我們SPEAR T-cell技術(shù)平臺用于惡性腫瘤患者的巨大價(jià)值肯定。我對Adaptimmune的團隊感到無(wú)比的驕傲,對投資人和患者的信任表示無(wú)比的感激,我們期望在未來(lái)的學(xué)術(shù)會(huì )議上展示更多數據。”
Adaptimmune是一家英國生物技術(shù)公司,專(zhuān)注于研發(fā)針對癌細胞內抗原的TCR-T細胞療法。在2017年下半年與GSK簽訂了一項價(jià)值3.5億美元的合作協(xié)議,之后又從OrbiMed Advisors LLC等著(zhù)名風(fēng)投公司獲得了1億美元左右的投資。
參考資料: Adaptimmune Announces that SPEAR T-cell Platform Delivers Initial Responses in Four Solid Tumor Indications
文鏈接:https://mp.weixin.qq.com/s/xTZnXrYP5eh_XwUS53Oe_w
【延伸閱讀】
2019年,國內企業(yè)香雪制藥旗下的香雪精準醫療(XLifeSc)研發(fā)的國內首個(gè)高親和性超強特異性T細胞注射液(“TAEST16001”)獲準臨床,創(chuàng )下國內新藥審批最快記錄。
今年,其將加快TAEST16001進(jìn)入臨床 I 期 ,并與臨床單位合作建立T細胞制備規范、臨床應用技術(shù)標準及評價(jià)系統,形成轉化醫學(xué)的研究和治療平臺以造福患者。 產(chǎn)業(yè)化布局方面,香雪制藥與美國GE醫療建立了緊密的戰略合作伙伴關(guān)系,建設全球領(lǐng)先水平的“細胞治療產(chǎn)業(yè)化區域制備平臺和臨床轉化中心”,共同推動(dòng)高親和性特異性T細胞受體(TCR)為核心的免疫治療藥物產(chǎn)業(yè)化。全球首次應用在TCRT相關(guān)免疫治療藥物開(kāi)發(fā)領(lǐng)域的GE細胞治療企業(yè)整體解決方案中的靈活生產(chǎn)平臺(FlexFactoryTM)落戶(hù)香雪制藥,并將于2020年正式投入使用。據介紹,該平臺將加速從實(shí)驗室向臨床轉化及商業(yè)化進(jìn)程,在行業(yè)內具有深遠意義。